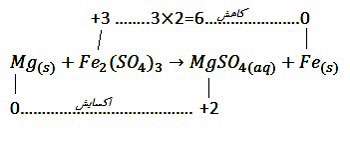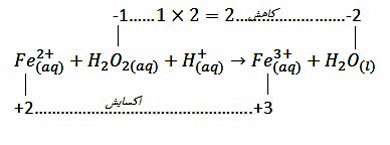درخواست های شما شما خالی است.
دستهبندی نشده
موازنه کردن
موازنه کردن معادله يک واکنش شيميايي
۱) روش وارسی
براي موازنه کردن يک معادله ي شيميايي بايستي ضرايب مناسبي براي واکشن دهنده ها و فرآورده ها انتخاب کرد تا تعداد اتمهاي هر عنصر در دو طرف معادله واکنش برابر شود. براي اين منظور چنين عمل مي کنيم:
۱- ابتدا معادله ي واکنش را با استفاده از نمادها و فرمولهاي شيميايي مي نويسيم.
۲- ترکيبي را که بيشترين تعداد اتم را دارد انتخاب می کنیم .
۳- موازنه تعداد اتم های عنصر فلزی در ترکیب انتخاب شده در دو طرف معادله .
۴- موازنه تعداد اتم های عنصرنا فلزی در ترکیب انتخاب شده در دو طرف معادله
۵-در نهایت ابتدا اتمهاي H و سپسO را موازنه مي کنيم.
۶- بر طبق قرارداد ضرايب بکار رفته در معادله واکنش بايستي کوچکترين عدد صحيح (غيرکسري ) باشند.
در مورد يونهاي چند اتمي مانند ،PO4–3 , SO4–2 وغيره بايد آنها را به صورت يک مجموعه يا ترکيب در نظر گرفت مثلاً تعداد کل بنيان SO4-2 را در دو طرف موازنه مي کنيم.
مثال
۱- معادله واکنش زير را موازنه کنيد.
C4H10 + O2 ——--> CO2 + H2
ابتدا C4H10 را براي شروع موازنه انتخاب مي کنيم چون بيشترين تعداد اتم را داراست.
براي موازنه C ضريب ۴ را براي CO2 قرار ميدهيم . براي موازنه H ضريب ۵ را براي H2O قرار ميدهيم.
C4H10 + O2 ———-> 4CO2 + ۵H2O
حال در طرف راست ۱۳ اتم O داريم . پس براي O2 در چپ ضريب ۲/۱۳ را قرار مي دهيم.
C4H10 + ۱۳/۲ O2 ———-> 4CO2 + ۵H2O
حالا کل ضرايب را در ۲ ضرب مي کنيم که ضريب کسري نداشته باشيم.
۲C4H10 + ۱۳O2 ———>8CO2 +۱۰H2O
۲- معادله واکنش زير را موازنه کنيد.
FeCl2 + AgNO3 ———--> Fe(NO3)2 + AgCl
موازنه را از بنيان چند اتمي NO3 شروع مي کنيم و ضريب ۲ را براي AgNO3 در سمت چپ قرار مي دهيم.
FeCl2 + ۲ AgNO3 ———-> Fe(NO3)2 + AgCl
حال براي آنکه Ag در دو طرف موازنه باشد ضريب ۲ را براي AgCl در سمت راست قرار مي دهيم.
FeCl2 + ۲ AgNO3 ———-> Fe(NO3)2 +۲ AgCl
حال معادله موازنه مي باشد.
تمرین
واکنش های زیر را موازنه کنید .
N2H4(l) + N2O4(l) ® N2(g) + H2O(l)
Cu(s) + HNO3(aq) ® Cu(NO3)2 (aq) + NO(g) + H2O(l)
H2C2O4(s) + NaOH(aq) ® Na2C2O4(aq) + H2O(l)
۲) اصل پایستگی جرم برای موازنه کردن واکنش های شیمیایی
روش کلی برای واکنش ها را از قانون پایستگی جرم و با در نظر گرفتن این که ، یک واکنش شیمیایی باید یک معادله شیمیایی باشد و یک معادله شیمیایی از نظر روابط کمی هیچ چیزی کمتر از یک معادله ریاضی ندارد ، می توان استنتاج کرد .
روش جمع جبری :
۱) اختصاص ضرائب a و b و c و….. به هر جز واکنش
۲) تعیین تعداد اتم های هر عنصر با استفاده از ضرائب و تشکیل معادله براساس موازنه
۳) تعیین رابطه ی بین ضرائب
۴) به بالاترین ضریب یک عدد نسبت بدهید ( معمولاً عدد یک )
۵) به کمک عددها واکنش را موازنه کنید
در این روش کلی برای هر یک از مولکول ها یا عنصرهای شرکت کننده در واکنش ، ضریبی مجهول در نظر گرفته می شود . در واقع موازنه کردن واکنش ، پیدا کردن همین ضرایب مجهول است . در این روش پس از یافتن روابط منطقی میان ضرایب ، با دادن مقدار یک به یکی از ضرایب ، معادله واکنش موازنه می شود .
مثال NaI + H2SO4 ———->H2S + I2 + Na2SO4 + H2O
۱- ضرایب مجهولی را به مولکول های مورد نظر نسبت می دهیم :
aNaI + bH2SO4 ————-->cH2S + dI2 + eNa2SO4 + fH2O
۲- بنا به اصل موازنه بودن واکنش های شیمیایی ، باید مجموع اتم های هر عنصر از هر نوع در دوطرف واکنش باهم برابر باشند ، پس داریم :
| Na | I | H | S | O |
| a=2e | a=2d | ۲b=2c + 2f | b=c+e | ۴b=4e + f |
۳- با قرار دادن یکی از ضرایب برابر با یک (e=1)معادله ها را ساده تر کرده و حل می کنیم :
a=2 , b=5/2 , c= ¼ , d= 1, f= 1
۴- عدد های بدست آمده را به جای ضرایب مجهول قرار می دهیم :
۲NaI + 4/5H2SO4 ————->4/1H2S + I2 + Na2SO4 + H2O
در یک معادله شیمیایی بایستی ضرایب عدد صحیح باشد . پس دو طرف معادله را در عدد ۴ ضرب می کنیم .
۴NaI + 5H2SO4 ————->H2S + 4I2 + ۴Na2SO4 + ۴H2O
مثال ۲:
P4 + H2SO4 ———-->H3PO4+ SO2 +H2O
اختصاص ضرائب به هر جز واکنش :
aP4 +bH2SO4 ———-> cH3PO4 +dSO2 + eH2O
تعیین تعداد اتم های هر عنصر و تشکیل معادله
P 4a=c
S b= d
H 2b= 3c+2e
O 4b= 4c+2d +e
با جایگزینی مقدار c و d خواهیم داشت :
H 2b= 12a+2e
O 2b= 16 a +e
a را برابر عدد یک فرض می کنیم
a=1
c=4
H 2b= 12+ 2e
O 2b= 16+e
با حل این دو معادله خواهیم داشت :
e= 4
b=10
d= 10
P4+10 H2SO4 ———-> 4H3PO4 +10 SO2 + 4 H2O
نکته : اگر معادله شیمیایی بصورت یونی باشد برای موازنه بار نیز یک معادله در نظر می گیریم .
تمرین :
معادله های شیمیایی زیر را موازنه کنید .
۱Pt + H+ + HNO3 + Cl– ————>PtCl62- + NO + H2O
۲Pb(N3)2 + Cr(MnO4)2 ———-->Pb3O4 + NO + Cr2O3 + MnO2
۱- ترکیب تجارتی KCN برای استخراج طلا از معدن استفاده می شود . طلا در محلول –CN در حضور هوا به شکل Au(CN)2– حل می گردد . معادله واکنش را نوشته و موازنه کنید .
۲- تیزاب سلطانی مخلوط ۳ به یک (حجمی) اسید کلریدریک و نیتریک اسید می باشد که توسط کیمیاگران برای حل طلا بکار برده می شد . واکنش با تشکیل AuCl4– و گاز NO پیش می رود . واکنش را نوشته و موازنه کنید .
۳) روش تعیین پارامتر موازنه
۱) تعییین ضریب یک برای ترکیب با بیش ترین تعداد اتم و انتخاب ضریب مناسب برای عنصری از این ترکیب که تنها در یک ماده دیگر وجود دارد
۲) انتخاب ضریب x برای پیچیده ترین ترکیب باقیمانده و ضریب های دیگر برای سایر مواد
۳ ) تعیین ضرائب برحسب x با توجه به قانون پایستگی جرم برای عنصر هایی که فقط در یک ماده وجود دارند
۴) تعیین مقدار x به کمک عنصری که تا کنون شمارش و موازنه نشده است
P4 + H2SO4 → H3PO4 +SO2 + H2O
اختصاص ضریب یک برای ترکیب با بیش ترین تعداد اتم( P4 ) و تعیین ضریب مناسب برای عنصری از این ترکیب که فقط در ماده دیگر وجود دارد ( P)
۱P4 +H2SO4 →۴H3PO4 +SO2+ H2O
تعیین ضریب x برای پیچیده ترین ترکیب باقیمانده و ضرائبy و zبرای سایر مواد
۱P4 + xH2SO4 → ۴H3PO4 +ySO2 + zH2O
تعیین ضرائب y وz بر حسب x برای عناصری که تنها در یک ماده وجود دارند براساس قانون پایستگی جرم ( S و H )
S X = Y
H 2X = 12+ 2Z
Z = 6 – X
۱P4 +xH2SO4 → ۴H3PO4 +xSO2 + (6-x)H2O
تعیین مقدار x به کمک عنصری که تا کنون شمارش و موازنه نشده است( O)
۴x = 16 +2x + 6 – x
x = 10
y= 10
z= 4
P4 +10 H2SO4 → ۴H3PO4 +10 SO2 + 4 H2O
۴)موازنه واکنشهای اکسایش ـ کاهش
در واکنشهای اکسایش ـ کاهش میتوان از تغییر عدد اکسایش برای موازنه واکنش استفاده کرد، در این مطلب قصد داریم با ذکر مثال به تشریح روش موازنهی واکنش های اکسایش ـ کاهش بپردازیم. با ما همراه باشید.
به واکنش زیر توجه کنید:

برای موازنه این واکنش ابتدا تغییر عدد اکسایش هر یک از عناصر را بدست میآوریم و اگر عنصری در سمت چپ واکنش زیروندی به غیر از یک داشت، تغییر عدد اکسایش را در آن زیروند ضرب میکنیم. توجه داشته باشید میزان تغییر عدد اکسایش بدون علامت در زیروند ضرب میشود.
Mgاکسایش یافته و کاهنده است.Fe کاهش یافته و اکسنده است.
حال در سمت چپ واکنش تغییر عدداکسایش مادهی کاهنده را به عنوان ضریب مادهی اکسنده و تغییر عدد اکسایش مادهی اکسنده را به عنوان ضریب مادهی کاهنده قرار داده و شروع به موازنه عناصر میکنیم.
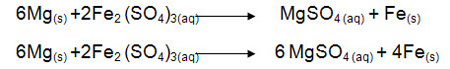
ضرایب را ساده میکنیم:

یک مثال دیگر: به موازنهی زیر توجه نمایید:
Fe اکسایش یافته و کاهنده است. O کاهش یافته و اکسنده است.
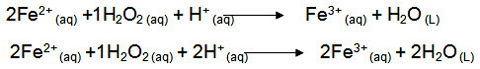
سوال:
نسبت مجموع ضرایب استوکیومتری فراوردهها به واکنش دهنده پس از موازنه این واکنش کدام است؟
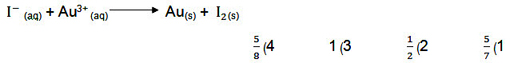
۵) موازنه به روش نیمه پیلی (یون – الکترون): در موازنه معادلات به روش یون- الکترون ، دو دستور کار که کمی با هم متفاوتاند، مورد استفاده قرار میگیرد. یکی برای واکنشهایی که در محلول اسیدی انجام میگیرد و دیگری برای واکنشهایی که در محلول قلیایی صورت میپذیرد.
- مثالی برای واکنشهایی که در محلول اسیدی رخ میدهد، عبارت است:
Cr2O7-2 + Cl– ———--> Cr+3 + Cl2
این واکنش موازنه نشده ، طی عملیات زیر موازنه می شود:
_ابتدا معادله را به صورت دو معادله جزئی که یکی برای نشان دادن اکسایش و دیگری برای نشان دادن کاهش است، تقسیم کرده و عنصر مرکزی را در هر یک از این نیم واکنش ها موازنه می کنیم:
Cr2O7-2 ——--> 2Cr+3
۲Cl– ———> Cl2
_اتمهای O و H را موازنه میکنیم. در سمتی که کمبود اکسیژن دارد، به ازای هر اکسیژن یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دیده میشود، با افزودن تعداد مناسب +H آن را جبران می کنیم. در مثال بالا، طرف راست ، معادله جزئی اول ۷ اتم اکسیژن کم دارد، پس به طرف مزبور ۷H2O افزوده میشود. پس اتمهای H معادله جزئی اول را با اضافه کردن چهارده +H به طرف چپ معادله، موازنه میکنیم. معادله جزئی دوم ، بصورت نوشته شده ، از لحاظ جرمی ، موازنه است:
۱۴H+ + Cr2O7-2 ———-> 2Cr+3 + 7H2O
۲Cl– ——--> Cl2
_در مرحله بعد ، باید معادلات جزئی را از نظر بار الکتریکی موازنه میکنیم. در معادله جزئی جمع جبری بار الکتریکی طرف چپ برابر +۱۲ و در طرف راست +۶ است. ۶ الکترون به سمت چپ اضافه میشود تا موازنه بار برای معادله جزئی اول حاصل شود. معادله دوم با افزودن دو الکترون به طرف راست ان موازنه میشود، ولی چون تعداد الکترونهای از دسترفته در یک معادله جزئی باید برابر تعداد الکترونهای بدست آمده در معادله جزئی دیگر باشد، بنابراین طرفین معادله جزئی دوم را در ۳ ضرب میکنیم:
۶e– + 14H+ +Cr2O7-2 ———-> 2Cr+3 + 7H2O
۶Cl– ————> 3Cl2 + 6e
_معادله نهایی ، با افزایش دو معادله جزئی و حذف الکترونها بدست میآید:
۱۴H+ + Cr2O7-2 + 6Cl– ———-> 2Cr+3 + 3Cl2 + 7H2O
- مثالی برای واکنش هایی که در محلول قلیایی صورت میگیرد:
MnO4– + N2H4 ———--> MnO2 + N2
_معادله به دو معادله جزئی تقسیم می شود:
MnO4– ————> MnO2
N2H4 ———--> N2
_برای موازنه H و O در این واکنشها ، درسمتی که کمبود اکسیژن دارد، به ازای هر اتم اکسیژن –۲OH و سمت دیگر یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دارد به ازای هر اتم هیدروژن ، یک H2O و در سمت مقابل یک –OH اضافه میکنیم. سمت راست معادله جزئی اول دو اتم O کم دارد. لذا –۴OH به سمت راست و ۲H2Oبه سمت چپ میافزاییم:
۲H2O + MnO4– ———--> MnO2 + 4OH
برای موازنه جرمی معادله جزئی دوم ، باید چهار اتم هیدروژن به سمت راست اضافه کنیم، لذا ۴H2O به سمت راست و –۴OH به سمت چپ اضافه میکنیم:
–۴OH + N2H4 ———-> N2 + 4H2O
_برای موازنه بار الکتریکی ، هر جا لازم است، الکترون اضافه میکنیم و در این جا بطرف چپ معادله جزئی اول ، سه الکترون و بطرف چپ معادله جزئی دوم ، چهار الکترون افزوده میشود و برای موازنه کردن الکترونهای بدست آمده و از دست رفته ، مضرب مشترک گرفته و معادله اول را در ۴ و معادله دوم را در ۳ ، ضرب میکنیم:
۱۲e– + 8H2 + 4MnO4– ————> 4MnO2 + 16OH
_جمع دو معادله جزئی، معادله نهایی را بدست میدهد:
۴MnO4– + 3N2H4 →۴OH– + 4MnO2 + 3N2 + 4H2O
مثال۲:
واکنش زیر را که در محلول اسیدی انجام میشود را موازنه میکنیم :

- معادله را به دو معادلهٔ جزئی تقسیم میکنیم و اتمهای را در هر کدام موازنه میکنیم :
- اولین معادلهٔ جزئی را میتوان با افزودن به سمت راست و به سمت چپ، موازنه کرد. در معادلهٔ جزئی دوم باید به سمت چپ اضافه شود تا تعداد اکسیژن موازنه شود و همچنین با اضافه کردن به سمت راست، تعداد هیدروژن هم موازنه میشود :

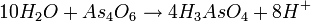
- حال بار الکتریکی خالص را در طرفین موازنه میکنیم :


- اولین معادله را در ۸ و دومی را در ۵ ضرب میکنیم :

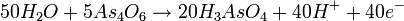
- حالا معادلهها را با هم جمع میزنیم و عبارتهای مشترک را در دو طرف، حذف میکنیم :